Биотехнологические проекты давно перешагнули из области научного знания в область промышленно-коммерческого использования. Научно-технический прогресс нашел применение результатам фундаментальных биологических и молекулярно-биологических исследований в сельском хозяйстве, пищевой промышленности и фармацевтике, медицине и приборостроении. Особенно широко в последнее время эксплуатируются достижения генетики и молекулярной биологии в сфере производства новых сортов сельскохозяйственных растений и пород животных, обладающих разнообразными новыми признаками, отсутствовавшими у родительских видов/сортов…
Быстрое и массовое производство таких сортов, легкость и научная предсказуемость приобретения ими заданных свойств привели к их широкому использованию. Так в настоящий момент посевы ГМО (генетически модифицированных организмов) во всем мире занимают площади более 67.7 млн. гектар.
И, вместе с тем, в последние годы резко обозначился вопрос – насколько безопасны данные технологии, насколько адекватно соблюдаются Международные руководящие принципы техники безопасности ЮНЕП в области биотехнолгии, принятые еще в 1995 г.
Аргументы сторонников соблюдения принципов предосторожности заставляют в настоящий момент правительства многих стран Европейского союза, Азии и Африки вносить корективы в сельскохозяйственную политику и отказываться от производства ряда сортов ГМО. В мировой литературе развернулась острая дискуссия об обоснованности декларируемых рисков применения ГМО.
Многие аргументы сторонников соблюдения принципов предосторожности получили экспериментальное подтверждение (см. обзоры М.С.Соколова с соавт. (1), М Джованнетти (2))
Цель настоящего обзора – попытаться дать объективную оценку в первую очередь пищевых рисков.
1. Классификация рисков
Встраивание в геном организма-хозяина новых конструкций имеет цель получить новый признак, недостижимый для данного организма путем селекции или требующий годы работы селекционеров. Но вместе с приобретением такого признака организм приобретает целый набор новых качеств, опосредованных как плейотропным действием нового белка, так и свойствами самой встроенной конструкции, в том числе ее нестабильностью и регуляторным действием на соседние гены.
Все нежелательные явления и события, происходящие при возделывании и потреблении ГМО, можно объединить в три группы: пищевые, экологические и агротехнические риски.
1.1. Пищевые риски
* Непосредственное действие токсичных и аллергенных трансгенных белков ГМО.
* Риски, опосредованные плейотропным действием трансгенных белков на метаболизм растений.
* Риски, опосредованные накоплением гербицидов и их метаболитов в устойчивых сортах и видах сельскохозяйственных растений.
* Риски горизонтального переноса трансгенных конструкций, в первую очередь в геном симбионтных для человека и животных бактерий (E.coli, Lactobacillus (acidophillus, bifidus, bulgaricus, caucasicus), Streptococcus thermophilus, Bifidobacterium и др.).
Экологические риски
* Снижение сортового разнообразия сельскохозяйственных культур вследс¬твии массового применения ГМО, полученных из ограниченного набора родительских сортов.
* Неконтролируемый перенос конструкций, особенно определяющих различные типы устойчивости к пестицидам, вредителям и болезням растений, вследствии переопыления с дикорастущими родственными и предковыми видами. В связи с этим снижение биоразнообразия ди¬корастущих предковых форм культурных растений и формирование «суперсорняков».
* Риски неконтролируемого горизонтального переноса конструкций в ризосферную микрофлору.
* Негативное влияние на биоразнообразие через поражение токсичными трансгенными белками нецелевых насекомых и почвенной микрофлоры и нарушении трофических цепей.
* Риски быстрого появления устойчивости к используемым трансгенным токсинам у насекомых-фитофагов, бактерий, грибов и других вреди¬телей, под действием отбора на признак устойчивости, высокоэффек¬тивного для этих организмов.
* Риски появления новых, более патогенных штаммов фитовирусов, при взаимодействии фитовирусов с трансгенными конструкциями, прояв¬ляющими локальную нестабильность в геноме растения-хозяина и тем самым являющимися наиболее вероятной мишенью для рекомбинации с вирусной ДНК.
Агротехнические риски
* Риски непредсказуемых изменений нецелевых свойств и признаков модифицированных сортов, связанные с плейотропным действием введенного гена. Например, снижение устойчивости к патогенам при хранении и устойчивости к критическим температурам при вегетации у сортов, устойчивых к насекомым-вредителям.
* Риски отсроченного изменения свойств, через несколько поколений, связанные с адаптацией нового гена генома и c проявлением как новых плейотропных свойств, так и изменением уже декларированных.
* Неэффективность трансгенной устойчивости к вредителям через несколь¬ко лет массового использования данного сорта.
* Возможность использования производителями терминальных технологий для монополизации производства семенного материала.
История вопроса
Риски, связанные с производством биотехнологической продукции, начали обсуждаться в научной литературе с 1983 г. (3, 4). К середине 80-х г. в развитых странах вырабатывается государственная политика по биотехнологии. Так, например, в США контроль за использованием ГМО находится в юрисдикции трех агентств, американского Агентства по охране окружающей среды, американского Министерства сельского хозяйства, и американского Управления по санитарному надзору за качеством пищевых продуктов и медикаментов. Существует так же координационный комитет, осуществля¬ющий согласованную работу всех трех ведомств по данному вопросу. Цели, задачи и законы, регламентирующие деятельность этого комитета, были опубликованы в 1986 г. (5).
Практические оценки влияния ГМО на организм при их пищевом потреблении появилсь недавно. Первые широкоизвестные работы по пищевым рискам ГМО принадлежат А.Пуштаи, работавшему в Исследовательском Институте Рауэтт, Великобритания (6–8) и стали предметом широко извес¬тной дискуссии 1999–2000 гг.
Однако возможность формирования выраженного иммунного ответа на трансгенный белок, являющийся аллергеном и потребляемый в составе растительного продукта, были известны и ранее.
Например, за три года до начала этой дискуссии, Х.С.Мэйсон с соавт. показали высокий иммунный ответ у мышей на трансгенный картофель, модифицированный капсидным вирусным белком (9). Поскольку работа была посвященна модели оральной иммунизации животных белками, продуцируемыми в трансгенных системах, результаты этой и подобных работ остались незамеченными для диетологов и аллергологов. Тем не менее, работы, посвященные механизмам иммунного ответа человека на лектины, в частности хлебного дерева и сои, связывающихся с иммуноглобулином IgA1 (10) и приводящим к слипанию эритроцитов (11), были хорошо известны.
А.Пуштаи показал влияние трансгенного картофеля, модифицированного лектином подснежника, на гистологическом уровне – на состояние слизистой оболочки кишечника, частичную атрофию печени и изменение тимуса, и на физиологическом – на относительный вес внутренних органов крыс, содержащихся 9 месяцев на соответствующей диете, по сравнению с контрольными, питавшимися нетрансформированным картофелем
.
На страницах «BINAS News» опубликована полемика 1999 года, как критика и опровержение результатов А.Пуштаи, например, Д.Гейтхаусом, Ф.Дали, Р.Д.Брауном, так и позиция сторонников точки зрения А.Пуштаи, Б.Мифлина, Ж.Рифкина и др. (12). Тогда-же Е.Дришш и Т.Бег-Хансен публикуют меморандум, поддержавший А.Пуштаи и основанный на экспертной оценке его результатов группой из 20-ти (помимо авторов меморандума) ученых. Собственно, результаты Пуштаи были представлены в научной прессе после проведения экспериментов и подтверждения заявленных результатов сотрудником Абердинского Университета, С.В.Ивеном (5,7).
Позднее появляются работы, проведенные на культурах клеток крови человека и колоректальной карциномы, подтверждающие результаты А.Пуштаи (13, 14), начинают разрабатываться методики, посвященные оценке пищевых рисков, связанных с действием потенциальных аллергенов (15, 16).
В обзорах по применению ГМО, авторы, в том числе и первоначально критиковавшие А.Пуштаи, указывают на необходимость строгой оценки пищевых и экологических рисков (17, 18).
Показательна история с сортом кукурузы StarLink®, скандал вокруг кото¬рой разгорелся в 2000–2001 гг. Эта кукуруза, трансформированная белком-токсином Bacillus thuringiensis Cry9C, была разрешена американским Агентством по охране окружающей среды к использованию с ограничениями, как кормовая культура в 1998 г.
Ограничение в использовании было вызвано результатами тестирования белка Cry9C на устойчивость к перевариванию пепсином и к нагреванию, показавшими устойчивость выше минимально допустимой (19).
В результате неконтролируемого переопыления с пищевыми сортами, урожай из гибридных растений был использован для получения пищевых продуктов. В 2000 г. фирма «Авентис» предоставила материалы, подтверждающие возможность использования сорта StarLink® в пищевых целях (20).
Данные экспериментов по оценке токсичности и аллергенности модифицированного продукта всего на 10 крысах, якобы свидетельствали о его безопасности. В пользу своей точки зрения «Авентис» указывала на 30-летний опыт применения белка Cry9C в США в качестве инсектецида, и отсутствие данных в научной литературе по токсичному и аллергенному действию белка Cry9C.
Ряд публикаций, посвященных оценке аллергенности и других возможных воздействий на организм подопытных животных белками Cry9C и родственного ему Cry1Ab, показали отсутствие патогенного действия данных белков в составе ГМО (21–23). Тем не менее, существующие данные по аллергенности токсинов B. thuringiensis (24) заставили провести дополнительные исследования аллергенности Cry–белков.
Были получены данные, свидетельствующие о выработке антител и, соответственно, формировании аллергичной реакции на белок Cry1Ac (25), и ограниченности методов определения иммунных реакций (26), в частности теста ELISA, не способного оценивать аллергенность гликозилированных эпитопов белков (27).
Гликозилирование – особенность многих аллергенов пищи (28), и известно, что Cry-белки имеют потенциально гликозилируемые участки (29), и взаимодействуют с мембранными аминопептидазами, что свидетельствует о наличии у Cry-белков гликозил-фосфатидилинозитольного мембранного якоря (30).
Эти данные подтверждают первоначально осторожную оценку в применимости сорта StarLink® (19, 31) и оправдывают постоянно ведущийся в США мониторинг сортов кукурузы и производимых из них пищевых продуктов на присутствие белка Cry9C (32).
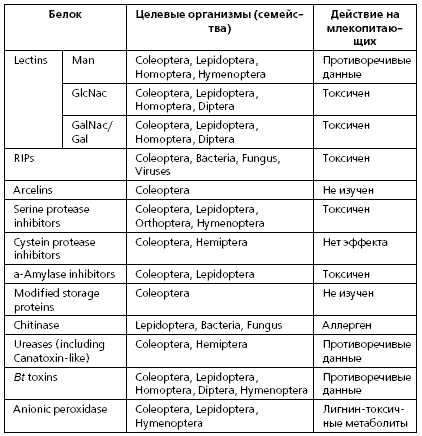
Свойства белков, обладающих бактерицидной, фунгицидной и инсектицидной активностью, используемых для трансформации сортов сельскохозяйственных растений
Как правило, токсичным или аллергеным действием обладают трансгенные белки, обеспечивающие устойчивость растений-реципиентов к поражению различными видами насекомых, грибковым и бактериальным заболевани¬ям. Устойчивость обеспечивается действием белков, обладающих набором специфициских свойств. Среди них:
* ферментативная активность к наиболее мажорным компонентам кле¬точной стенки целевых организмов (например, хитиназы для насекомых и грибов),
* лектиновая активность (лектины и арселины), опосредующая связыва¬ние с определенными рецепторам и мембранными гликопротеинами и реакции гликозилирования и приводящая к слипанию клеток желудочно-кишечного тракта и нарушению работы пищеварительных ферментов насекомых – вредителей,
* ингибирование рибосомальных белков (RIPs-белки), приводящее к нарушению синтеза новых белков клетками, контактирущими с RIPs,
* ингибирование функций пищеварительных протеаз и амилаз целевых организмов,
* формирование сквозных каналов в клеточной мембране (Cry- проток¬сины Bacillus thuringiensis, активизирующиеся после протеолитического расщепления), приводящее к лизису атакованных данными полипептидами клеток,
* проникновение в виде фрагментов исходного белка через стенки кишечника и связывание с ганглиозидами клеточных мембран (растительные протоксины: уреазы и канатоксины), что приводит к экзоцитозу клеток различных типов, разрушению кровяных пластинок и сопровождается гибелью целевого организма.
Табл.1 Действие некоторых растительных и бактериальных токсинов на целевые организмы и человека (19–30, 33–72).
Устойчивость к патогенам и вредителям формируется благодаря экспрессии генов этих белков под действием тканеспецифичных промоторов в целевых тканях и органах растения. В настоящий момент практически все перечисленные классы белков используются при создании коммерческих сортов пищевых и кормовых растений.
*** сокращено много интересного ***
Другим эффективным и распространенным гербицидом является атразин.
Устойчивость картофеля и табака к его действию обеспечивается встраиванием в геном цитохрома CYP1A1, представителя класса P450 цитохромов (81, 82). Вместе с тем, известно немало работ, посвященных канцерогенным, иммунотоксичным и эмбриотоксичным свойствам этого вещества (например 83, 84). И в этом случае вопрос о накоплении этого гербицида в устойчивых к нему сортах не привлекает внимания разработчиков. А пищевой риск такого накопления огромен.
Риски, связанные с плейотропными влияниями трансгенных белков и конструкций, определяющих устойчивость к гербицидам, мы рассмотрим в следующем разделе.
Модификация метаболизма и плейотропные влияния трансгенных белков.
Пищевые риски могут быть связаны с действием плейотропных эффектов как самих трансгенных белков, так и регуляторным действием встроенных конструкций. Выше уже упоминалось усиление активности уреаз в трансгенном сорте сои, устойчивой к гербициду раундап (36).
Несмотря на правила валидации трансгенных сортов, обнаружить нецелевые изменения метаболизма, активности различных белков, включая лектины и фитогормоны, не просто – исследователь не знает точно, что проверять. Изменения могут быть не количественными, а качественными, например, состава минорных фракций гликоалкалоидов, которые совместно могут обладать многократным синергетическим усилением мембранолитической активности.
Существуют ли объективные основания для таких опасений? С конца 90-х годов проводилость изучение биосинтеза флавоноидов, природных антиоксидантов, участвующих в защите тканей растения от негативных последствий фотохимических реакций, на модели трансгенных растений (85). В настоящий момент существуют трансгенные сорта помидоров (86) и картофеля (87) с усиленной продукцией флавоноидов. Принято считать, что повышенное содержание флавоноидов на организм человека положительно. Но такое изменение метаболизма растений может приводить к росту пищевых рисков.
Так, масс-спектрофотометрический анализ трансгенного картофеля показал резкое изменение состава минорных фракций гликоалкалоидов (87). Для оценки пищевых рисков в таких случаях необходимо проведение долговременных тестов, которые пока не проводятся.
Проводя работы по созданию трансгенных растений с устойчивостью к стрессующим факторам и для увеличения урожайности, используют ключевой фермент синтеза полиаминов – аргинин декарбоксилазу (88). Результатом гиперэкспрессии этого фермента у трансгенных табака и риса является повышенное содержание агматина – его непосредственного метаболита, и в ряде случаев – рост концентрации вторичных метаболитов путрисцина, спермидина и спермина (88, 89).
При этом как агматин, так и его производные, являются биологически активными веществами, способными взаимодействовать с адренэргическими, имидазолиновыми и глутаматными рецепторами, выступая для организма человека в роли как нейромедиаторов, так и активаторов мито¬за и способствуя опухолеобразованию (90, 91). Будучи небелковой природы, эти вещества легко усваиваются организмом. Адекватность используемых в настоящий момент тестов для проверки таких рисков сомнительна.
Не обойдены вниманием производителей и цитокинины – растительные гормоны, производные пурина.
Сорта томатов, модифицированных генами изопентилтрансферазы и бактериальной фитоэнсинтазы, обладают повышенной продуктивностью (92, 93). Однако сложнейшая регуляторная сеть, включаемая действием цитокининов в организме растения и затрагивающая как метаболизм, так и разнообразные тканевые и ростовые процессы, только изучается (94), и предсказать все эффекты от такого рода изменений пока невозможно. Но показано, что содержание фитогормона зеатина пуринового ряда и его производных растет (94а).
Известны сильнейшие эффекты этих гормонов на клетки человека и млекопитающих различных типов (95, 96), за счет модуляции Ras – опосредованных клеточных сигнальных каскадов (97), ацетилхолинэстеразной активности (98), активности пуринорецепторов (99). Пока допустимые безопасные концентрации используемых фитогормонов в растительных продуктах не будут определены, остается высоко вероятным пищевой риск с использованием этих технологий.
У сорта пшеницы, модифицированного кислой глюконазой и хитиназой, наблюдалась гиперэкспрессия специфицеской фенилаланин-аммоний лиазы и связанное с этим накопление салициловой кислоты, приводящее к некрозам растительной ткани (100). Сама салициловая кислота обладает массой полезных свойств, и в модифицированном виде хорошо известна как аспирин, вот только в качестве пищевой добавки к хлебу или макаронным изделиям она может не подойти.
Риски производства фармацевтических препаратов в ГМО.
В 2003 г. возник термин «Фармагеддон» (101). Основанием служит большое число сортов риса и кукурузы, разрабатываемых и культивируемых различ¬ными биотехнологическими компаниями, несущих биологически активные вещества, в том числе: вакцины, гормоны роста, факторы свертывания крови, индустриальные энзимы, человеческие антитела, контрацептивные белки, подавляющие иммунитет цитокины и вызывающие аборт препараты. Существуют (101, 102) следующие риски неконтролируемого использования такой продукции:
* угроза переопыления и неконтролируемого распространения таких сортов среди пищевых;
* риск неконтролируемого экспонирования пищевых вакцин беременным;
* распространение вакцин и биоактивных веществ, выделяющихся в естественных условиях из растительных остатков через почвенные и поверхностные воды.
Насколько обоснованы эти риски?
При переносе пыльцы растений ветром или насекомыми на места произрастания других сортов этого же вида, а также при случайном смешивании сортового материала, образуются гибридные растения, несущие признаки обоих сортов. Пример с сортом кукурузы StarLink® – не единственное подтверждение реальности таких рисков.
В Мексике и Гватемале дикорастущие виды кукурузы уже плотно насыщены трансгенными вставками, за счет переопыления с возделываемыми культурными сортами (1). В то же самое время, на рисовых полях Калифорнии среди пищевых сортов риса проводятся открытые полевые испытания сортов риса, несущего человеческие белки лактоферрин и лизозим, используемые в фармакологии при энзимотерапии.
Американская компания «Эпицит» недавно сообщила о создании и испытаниях сорта кукурузы, вырабатывающего человеческие антитела на поверхностные белки спермы, с целью получения противоза¬чаточных препаратов (102). Неконтролируемое переопыление такого сорта с пищевыми может привести к серьезным демографическим последствиям на территориях, где производится подобная продукция.
Неконтролируемое распространение вакцин в составе пищевых продуктов обладает не меньшим риском. В ходе эмбриогенеза формирующаяся иммунная система «учится» распознавать «свои» белки, не путая их в дальнейшим с «чужими». Белки, экспонируемые клеткам иммунной системы во время эмбриогенеза, запоминаются как «свои». Если белок вакцины в это время попадет в кровоток эмбриона, то родившийся ребенок не сможет вырабатывать иммунитет к данному заболеванию, всегда распознавая данную бактерию или вирус как «свой».
При сборе урожая любой пищевой культуры огромная масса растительных остатков – листвы, стеблей и корней, остается на полях. Вероятность прямого распространения в почвенных водах белков, входящих в состав растений, низка, хотя значительно выше вероятность горизонтального переноса трансгенных конструкций в почвенных и других бактерий (см. далее). Но, кроме этого, существует еще один аспект рисков – это неконтролируемая вакцинация птиц и млекопитающих, обитающих в данной местности.
Если трансгенные вакцины направлены против бактерий и вирусов, имеющих местных животных в качестве переносчиков (или бактерий, родственных человеческим болезнетворным бактериям), то такая вакцинация спровоцирует мощный отбор среди патогенов и формирование суперинфекций.
Риски горизонтального переноса трансгенных конструкций.
Горизонтальный перенос генов широко известен в царстве бактерий. В ходе эволюции обмен генами осуществлялся как между ними, так и между бактериями и эукариотами. Способность обмениваться участками генома бактерии сохраняют до сих пор. И это свойство бактерий имее прямое отношение к экологическим и пищевым рискам испольгования ГМО.
Нахождение в желудочно-кишечном тракте в составе пищи собственно ферментов, использующих антибиотик как субстрат, практически безопасно для человека и животных. Ферментам необходимы строго определенные условия для проявления активности, поэтому белки, осуществляющие внутриклеточный метаболизм, функционировать будут только в составе живой клетки.
Вероятность встраивания трансгенной конструкции из растения в геном млекопитающих и человека ничтожно мала. Следует учитывать, что клетки высших эукариот имеют несколько изолирующих барьеров, эффективно препятствующих горизонтальному переносу. Даже в случае такого переноса клетка, как правило не размножается, находясь в терминальной стадии дифференцировки.
Перенос конструкции в половые клетки вообще невероятен, учитывая гемато-тестикулярный барьер, не проницаемый для крупных молекул. Но не следует забывать, что человек имеет эндосимбионтов, в частности, кишечную бактериальную флору. Известно, что бактерии способны к трансформации как кольцевыми, так и линейными формами ДНК с инвертированными повторами (103).
Фрагменты трансгенной ДНК в содержимом кишечника, крови и молоке животных, питающихся ГМО (у коров – 104, у свиней – 105). При этом, в соответствии с часто применяемой методикой отбора трансгенных конструкций под действием антибиотиков, эти фрагменты несут репортерные гены устойчивости к антибиотикам в качестве маркерных последовательностей (77, 106). Эти гены могут быть как молчащими, так и нормально экспрессирующимися. В любом случае, трансформация ими симбионтных или патогенных бактерий может «включить» их уже в составе бактериального генома, например, путем рекомбинации и возникновения т.н. химерных белков, обладающих ферментативной активностью по отношению к антибиотику.
Это ведет к формированию устойчивости к антибиотикам или самих симбионтных бактерий, или патогенной флоры. Результатом использования антибиотика при заболевании будет быстрый отбор бактерий, устойчивых к нему, и антибиотик либо начнет перерабатываться непосредственно в кишечнике, не достигая целевых патогенных бактерий, либо не будет оказывать влияния на резистентные к нему патогены.
Поскольку основные бактерии-симбионты живут в толстой кишке, риск метаболизма антибиотиков бактериями кишечной флоры касается, в основном, плохо всасывающихся антибиотиков, например неомицина и канамицина. Трансгенные конструкции, несущие в качестве маркерного признака устойчивость как раз к таким препаратам, и были широко использованы биотехнологическими компаниями.
Сценарии риска трансформации бактерий растительными конструкциями подвергались критике, например А.Л.Коновым (107), на основании экспериментальных данных, демонстрирующих низкую частоту передачи наследственного материала от ГМО-организмов болезнетворным бактериям.
Обратимся к цифрам и фактам.
Порядок частот трансформации для разных штаммов бактерий при обнаружении трансформированных колоний составлял 10-4 –10-8 , при отсутствии таковых – не выше 10-16 . Число симбионтных бактерий в одном грамме содержимого кишечника достигает 10-11 .При пересчете на общее содержимое кишечника это даст вполне высокую вероятность трансформации бактерий-симбионтов.
Для Escherichia coli давно известно большое число патотипов, имеющих различия от нескольких до 1387 новых генов, расположенных в штамм-специфических кластерах и приобретенных в разное время путем горизонтального переноса (108, 109). То-есть, горизонтальный перенос генов для нее не исключительное событие.
Что касается передачи устойчивости к антибиотикам между различными бактериями, то это вполне доказанное явление. Был показан перенос устойчивости к антибиотикам от патогенных Acinetobacter baumannii к E.coli и Proteus mirabilis (110). Действительно, эффективная бактериальная система переноса генов устойчивости к антибиотикам представлена IncQ-подобными плазмидами, передающимися между E.coli, Acinetobacter sp. и другими штаммами бактерий (111). И вероятность формирования рекомбинантных плазмид, несущих новые гены из конструкций, с новой устойчивостью к пока эффективным антибиотикам, пока никак не оценивалась.
В связи с изложенным выше материалом по свойствам белков с инсектицидной активностью возникает еще один риск – формирования новых патогенных штаммов E.coli. Показано, что широко используемый в трансгенных конструкциях 35S промотор вируса CaMV, контролирующий экспрессию целевого гена, распознается транскрипционным комплексом широкого спектра видов бактерий (112, 113). При этом велика вероятность получения химерных белков с непредсказуемыми свойствами. Какова специфичность экспрессии других используемых промоторов – предстоит оценить, и без такой оценки говорить о безопансости используемой ГМ-технологии.
В некоторых работах оценка рисков горизонтального переноса проводится на основе анализа методами ПЦР (полимеразной цепной реакции) мускулатуры животных, питающихся трансгенной растительной пищей (114). Очевидно, подобный подход совершенно не обоснован, и отсутствие маркеров конструкций в мускулатуре, вполе ожидаемое, никак не связано с реальными рисками горизонтального переноса.
Характеристики плейотропных влияний (или отсутствие таковых) встроенных генов и конструкций, проведенные с непосредствнно полученным сортом, должны меняться с течением времени. Это связано с нестабильностью ряда конструкций, способных к перемещению в геноме и амплификации с течением времени. Уже известны примеры по изменениям в геноме трансгенных растений, связанные с наличием «горячих точек» рекомбинации в конструкциях (115). Эти процессы резко снижают надежность и устойчивость однажды заявленных производителями свойств новых трансгенных сортов.
Критика метода отбора трансформированных культур по устойчивости к антибиотикам привела к тому, что использование репортерных генов устойчивости к антибиотикам запрещено для получения новых пищевых сортов, такие сорта изымаются из обращения. Тем не менее, во многих случаях использование плазмид, содержащих нетранскрибируемые копии генов устойчивости к антибиотикам продолжается.
И продолжается использование таких запрещенных сортов: согласно сообщению Mr. Morley от 25 июня 2003 года в Английском парламенте, в Англии на полях с ГМО сортами растений были найдены сорта, несущие гены устойчивости к канамицину и неомицину, ампициллину и амоксициллину, и к гидромицину.(115а)
Заключение
Отмеченные выше факты неблагоприятного воздействия трансгенов на организм человека и животных не свидетельствуют о порочности технологии создания ГМО как таковых. Мы обращаем внимание на актуальность проблемы анализа пищевых и прочих рисков использования ГМО, на необходимость выработки норм экспертизы и тестирования новых сортов, с учетом уже известных рисков и постоянному жесткому контролю ГМО по исходным, не модифицированным сортам.
Безусловно, оценка таких рисков всегда будет относительна – любые употребляемые нами продукты питания способны осуществлять разнообразные воздействия на организм, а в процессе производства любой пищевой продукции происходит вмешательство человека в окружающую природу.
Имеющиеся данные, лишь часть которых была кратко описана в настоящем обзоре, показывают, что есть немало уже доказанных случаев реальных пищевых рисков, связанных с использованием генетически модифицированных организмиов по сравнению с исходными организмами.
Однако в условиях монополизации и производства семенного материала, и его экспертизы одной или несколькими крупными биотехнологическими корпорациями трудно ожидать объективных оценок этих рисков. В результате, проблема «регуляции рисков» может превратиться в проблему «рисков регуляции» (116, 117).